1. RESUMEN:
En la presente practica de laboratorio se determino la
densidad de dos liquidos recogiendo muestras a diferentes temperaturas y
determinando su densidad.
INTRODUCCIÓN:
Separación de los componentes de
una muestra acetona/agua por el método de destilación.
El método de destilación consiste en calentar un
liquido (mezcla) hasta que sus componentes mas volátiles pasan a fase de vapor
para recupera el componente de una forma mas pura por medio de la condensación.
Siendo objetivo principal separar una mezcla de varios
componentes aprovechando sus distintas volatilidades, o bien separar los
materiales volátiles de los no volátiles.
2. OBJETIVOS:
·
Comprender y analizar los
principios básicos de la destilación simple y fraccionada.
·
Utilizando el método de
destilación, separar la mezcla de dos líquidos solubles entre si que tienen
diferente punto de ebullición.
·
Determinar la densidad de cada una
de las fracciones obtenidas.
·
Determinar la composición final
del destilado y los fondos.
3. MARCO TEÓRICO:
NOTA: guía adjunta para
la elavoración del laboratorio: destilación.
4. MATERIALES Y REACTIVOS:
2 Beaker de 100 ml 2 mangueras 1 tripode
1 picnometro de 10 ml 1 nuez 4 perlas de
ebullición
1 balanza 1 pipeta de 1
ml 1 malla de asbesto
1 mechero
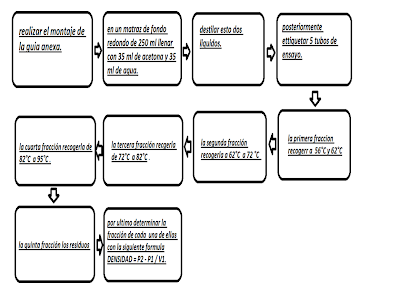
5. PROCEDIMIENTO:
6. DATOS Y CÁLCULOS:
Peso de la probeta vacía 54,1 gr.
1 densidad
de 56°C a 62°C peso: 68.3 – 54.1= 14.2gr V= 18 ml
DENSIDAD = 14.2gr ÷ 18ml = 0.788 g/ml
2 densidad de 62°C a 72°C peso: 55.2 – 54.1= 1.1gr V=1,3ml
DENSIDAD = 1.1gr ÷ 1.3ml = 0.846 g/ml
3 densidad de 72°C a 82°C peso: 55.4 – 54.1= 1.3gr V= 1.49ml
DENSIDAD = 1.3gr ÷ 1.49 = 0.87g/ml
4 densidad de 82°C a 95°C peso: 54.2 – 54.1= 0.1gr V= 0.11ml
DENSIDAD = 0.1gr ÷ 0.11ml = o.90 g/ml
5 densidad de residuos: peso: 85.7 – 54.1= 31.6gr V= 32.2ml
DENSIDAD = 31.6g ÷ 32.2ml = 0.98 g/ml
7.
CUESTIONARIO:
1.
¿Por qué no
se debe llenar un matraz de destilación mucho más de la mitad de su capacidad?
R= Para que las salpicaduras no salten al tubo
refrigerante.
2.
¿Por qué no
se evapora de repente todo el líquido del matraz de destilación cuando se
alcanza el punto de ebullición?
R= Porque en el punto de ebullición coexisten las
formas líquida y vapor. La energía que se absorbe a esta temperatura se
invierte en el paso de la estructura molecular del líquido al vapor y no en
aumentar la temperatura del líquido (por eso la temperatura permanece constante
durante la mayor parte del proceso)
3.
Un líquido orgánico empieza a descomponerse a
80°C. su tensión de vapor es entonces de 36 mm de mercurio. ¿Cómo se podría
destilarse este líquido?
R=Un líquido
orgánico comienza a descomponerse a 80°C. su tensión de vapor es entonces de 36
mm ¿cómo se puede destilar el líquido?
En estos
casos, se utiliza una destilación al vacío, ya que un líquido bulle cuando su
presión de vapor se iguala con la P externa. si uno baja la presión, hace que
la presión de vapor se iguale con la externa a una temperatura menor que la de
ebullición normal, que es a 1 atm de presión. Entonces, se puede destilar con
una temperatura menor a la cual descompone. En este caso por medio del vacío se
hace que la presión baje por ende la temperatura de ebullición también
disminuirá.
4.
¿Por qué hay que realizar las destilaciones
fraccionadas de una forma lenta?
R= Porque así se favorece el establecimiento del
equilibrio entre la forma líquida y vapor, haciendo que la separación sea más
efectiva y que el vapor liberado no arrastre moléculas del componente menos
volátil.
5.
Cátese dos
razones que justifiquen el que el agua fría en un refrigerante se haga circular
en sentido ascendente desde la tabuladora inferior a la superior y no al
contrario.
R= Si se
realiza el recorrido del agua en contracorriente con el vapor destilado el agua
logra absorber todo el calor esto hace que el vapor del destilado se convierta
rápidamente en liquido
Si se coloca
de arriba hacia abajo el agua va a caer sin hacer ninguna presión, lo que hace
que el tubo interno del condensador por donde va a pasar el vapor del destilado
no se enfría lo suficiente esto hace que del condensador salga el vapor de lo
que se pensaba destilar.
No hay comentarios:
Publicar un comentario